2016-09-23 10:42 来源:未知 编辑:admin
9月份,在北京市中关村生命科学园,百济神州就待满5年了。不到5年时间,这家中国创新药领军企业已有4款候选新药进入临床审批阶段,其中1款为单克隆抗体类抗癌药物(简称单抗药)。然而,在“中国版基因泰克(GenenTech)”的盛名之下,百济神州有着不大够用的公司大楼。
不只对物理空间,百济神州对人才储备、制药能力也相当“饥渴”。百济神州是中国创新药的一个典型标本。它标记出创新药要涉险跨过的每一道关卡:技术关、人才关、资本关、审批关。在这条荆棘路上,每位不甘于模仿的创新者,都需要跨山渡海,探索技术与商业的边界。
好在,百济神州获得了诸多美国投资机构的认可,并在今年2月登陆纳斯达克上市。而另一家生物医药CRO(俗称研发外包)领头羊药明康德则反向而行,从纽交所退市,准备在中国主板上市,市场预计市值将达到千亿以上。
不到半年,中央层面已经先后印发三个文件,对生物药构成一系列利好:
——3月,国务院办公厅印发《关于促进医药产业健康发展的指导意见》指出,加快新型抗体、蛋白及多肽等生物药研发和产业化。
——5月,中共中央、国务院印发《国家创新驱动发展战略纲要》指出,研发创新药物、新型疫苗、先进医疗装备和生物治疗技术。
——7月,国务院印发《“十三五”国家科技创新规划》要求,重点支持创新性强、疗效好、满足重要需求、具有重大产业化前景的药物开发,基本建成具有世界先进水平的国家药物创新体系,新药研发的综合能力和整体水平进入国际先进行列,加速推进我国由医药大国向医药强国转变。
至少在宏观政策层面,这是中国创新药最好的时代。
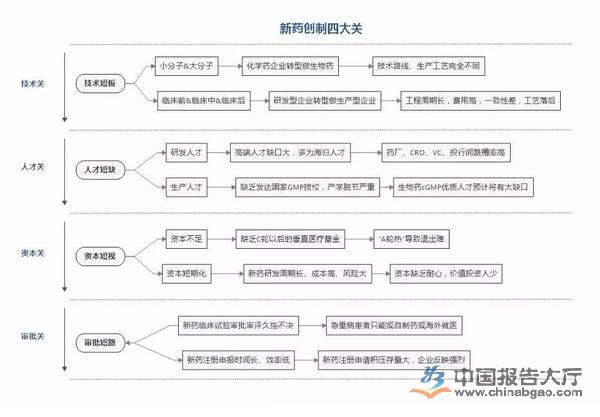
技术关:从研发到生产的难题
政策趋于利好,而竞争则愈发激烈。
随着创新药逐步进入临床阶段,从研发起家的生物技术公司百济神州,要为中试生产打好提前量,建设自己的生产基地,但生产环节并非这家公司专长。更重要的是,百济神州自主研发的肿瘤治疗的PD-1抗体药物,正面临诺华等跨国巨头的凶猛追赶,为争取三四年内将新药推向市场,百济神州需要更专注于研发,然后把生产等其他事务,交由外部服务商提供。
这时候,GE来了,希望在百济神州面前扮演“技术管家”的角色。
GE旗下的GE生命科学计划为百济神州建设一个cGMP中试车间,用于为该款生物药的临床试验提供样品。百济神州生物药首席总监李康对GE提出需求,希望GE确保生物制药生产制造流程不仅符合中国GMP标准(cGMP),还能符合美国、欧盟GMP标准,确保百济神州新药未来顺利出口欧美。他的需求得到回应——两者在8月订立了协议。
百济神州在中国率先采用的,是GE的Flexfactory?(灵活工厂)。该工厂位于苏州工业园区,预计于2017年开始运营。模块化生物制药整体解决方案KUBio?当中,Flexfactory?是指除厂房之外的模块。在此之前,作为全球首个符合国际标准的模块化生物药物工厂,喜康生物制药工厂(武汉光谷)就使用了GE的KUBio?解决方案。
GE医疗集团生命科学部大中华区总经理李庆分析道,客户将整体化地使用GE提供的产品和服务。这对GE的产品质量、自动化平台、售后服务等方面的要求会更高。相对于以前一次性售卖设备,GE与客户之间的关系将更加具有战略性,而非“一锤子买卖”。
和百济神州类似,越来越多的新药研发、CRO(研发外包)公司涉足下游的制药工业。李康坦陈,像百济神州这样的研发型企业,生产环节的能力就相对薄弱,希望利用GE等大公司在生产环节的知识积淀。同时,百济神州喜欢一站式解决方案,不需要费时费力去找很多不同的外部供应商。
人才关:五年内人才短缺难解
有了技术专利后,许多生物药公司发现,工程化研发、生产的人才却跟不上。
最近,康宁杰瑞找到公司所在地的苏州大学,与基础医学生物科学学院合办了“创新创业班”。该院将选拔本科生,在康宁杰瑞实习1~2年,培养学生将创新思想转化为生产力的能力,而不局限在在实验室做基础研究。国家“千人计划”特聘专家、康宁杰瑞总裁徐霆说,之所以选择校企合作,是为了提早储备人才梯队,抢占优质人才。
康宁杰瑞已是业内技术成熟的蛋白质化学公司,尚且如此,大部分转型做生物药的化学药企业,人才储备更不容乐观。
生物药市场诱惑着越来越多的新来者。在全球市场上,最畅销的10款治疗性药物中,有7款属于生物药。而中国在生物药产业还有很大的市场空间,李庆说,中国生物药只占医药产业市场份额4%,而美国的比例是22%,而且全球的市场还以每年10%速度增长。而想要分食生物药这块大蛋糕,所有市场参与者都需要跨过人才关。
“中国生物药人才短缺,在五年内都很难得到根本解决。”李庆举了个例子:就生产环节、技术、工艺而言,单抗药比化学药复杂得多,因此不确定性也要大得多。因此,两家公司同时做一款单抗药,结果双方在纯度、收益上有很大区别,主要是人才结构、层次等造成的。
李庆进一步分析道,当下,单抗药的顶尖人才基本都是国外回来的,由于产业化程度还很低,大部分新药还处在临床报批阶段,很难一下子投入巨资,用于吸引、培养人才。结果是,中国生物药的药厂、CRO、投行、VC机构之间的人才流动非常高。
除了研发人才,生产人才的培养同等重要。曾在多家跨国公司担任首席研究员的徐霆介绍说,拜耳所在的德国有好多高端GMP技校。美国波士顿也有同样的学校,由麻州州政府资助。徐霆说,这些技校直接服务于生物药的产业集群,招收的不一定是本科生、硕士生,因为GMP人员每天干的是每天单一、重复技能,学历太高的人不一定能够坚持。
但中国药企很难一蹴而就。徐霆提醒道,美国的生物药产业发迹于1970年代中期,40多年相对成熟产业。而亚洲的韩国、新加坡也将生命科学作为国家战略,从欧美引进高级人才,由于国家小,人才需求不像中国那么大,这种方式可以在短期内满足高端人才需求。
资本关:有投资人抱怨“烧钱”搞研发
根据塔夫茨药物开发研究中心提供的一项数据显示,开发一个新药的平均成本大约为26亿美元。即便有了技术专利、人才储备,也要有支付得起研发费用、人工成本的持续资金投入。如果再算上研究路线错误、临床审批未通过的风险,部分甚至全部资金投入存在打水漂的可能性。
因此,抗肿瘤创新药起家的百济神州需要多费些口舌,向投资人介绍市场前景:中国每年大概有429万人患癌症,每天有一万一千多人新患癌症。每年有289万人死于癌症,平均每天有7711人死于癌症。适用于肿瘤治疗的癌症病人差不多至少有100万人。李康透露,对抗肿瘤创新药研发企业的估值,由于国内市场投资人不如美国市场积极,百济神州最终还是选择赴纳斯达克上市。
不过,也有中国投资人对创新药表示乐观。元禾原点是A轮融资额最大的一宗生物药投资案例——基石药业的领投方。元禾原点合伙人赵群感慨,两三年前,当VC机构大多在投资Me-too(有自己知识产权、其药效和同类的突破性的药物相当的药物——作者注)、Bio-similar(生物仿制药)的时候,元禾原点已经开始布局价值被低估的创新药,事实证明,创新药为元禾原点创造的收益率,远高于类似药、仿制药。
相对于互联网、IT行业,生物医药行业资本不足是一个显著问题。清科数据显示,2016年上半年,生物技术/医疗健康行业的投资额为41.81亿元,而互联网行业的投资额为219.41亿元,前者仅为后者不到五分之一。
赵群坦言,创新药到了Ⅱ、Ⅲ期临床的项目募资额都达到数亿元人民币。这两年生物药投资“A轮热”,大家也要考虑B轮、C轮等长周期的退出问题。今年,医药行业的天使基金募资额下降,也有LP(有限合伙人)对新基金在B轮、C轮退出的判断趋于谨慎。
而资本短期化,是另一个显著问题。曾旅美多年的徐霆感慨说,美国的资本宽容度很高。同时,美国公司上市相对于中国容易。上市后,作为公众公司,可以从PIPE、IPO、增发等更多渠道募资。美国有好多生物技术的上市公司,成立30多年了,1个上市品种都没有,照样没有退市,“这在中国不可想象”。
曾有投资人抱怨,自己投资的生物科技公司,把募得资金都用来研发了。但徐霆不认可这一观点,他认为,搞研发是生物技术公司本分。中国需要更有耐心、更有远见的投资人,同时需要不同体量之间资本的“接力”。当然,也要照顾到商业模式的平衡,资本都是逐利的,如果不能给VC退出、增值的机会,至少要给它足够的希望。
审批关:须打通新药上市“最后一公里”
即便技术、人才、资金万事齐备,生物药依然要面临最后一关——行政审批。
贝达药业自主研发的抗癌药凯美纳,使中国成为继美、英之后拥有完全自主知识产权靶向抗癌药的第三个国家。今年1月份,贝达药业自主研发产品“小分子靶向抗癌药盐酸埃克替尼开发研究、产业化和推广应用”项目被授予国家科技进步一等奖。有券商研报指出,以贝达药业、恒瑞医药、中恒集团、天士力等为首的创新药研发龙头企业将由此迎来利好。
今年6月,在苏州生物纳米园举办的首届新药创始人俱乐部年会上,贝达药业董事长丁列明在演讲中反思到,我国医药创新能力不足,需要更好的配套政策。他提出几点建议:
1、提高药品审批标准,调整新药与仿制药的定义。
2、加快创新药的审评审批,对创新药实行特殊审评制度。
3、加强审批队伍建设,外聘行业专家参与有关技术审评。
4、简化药品审批程序,完善药品在注册制度。
5、提高仿制药质量,加快仿制药质量一致性评价。
两个月多月后,中纪委网站刊发了中共国家食药监总局(CFDA)党组对中央巡视组巡视意见的整改通报,直言新药创制存在“由于药品注册审批程序设置不够科学,受理、检验和审评、审批等环节衔接不顺畅,以及审评专业人员力量不足,造成注册审批时间长、效率低,积压药品注册申请,企业反映强烈”等一系列问题。
中共CFDA党组对此透露出不少政策信号:“下一步,按照国务院部署,认真组织开展药品上市许可持有人制度试点工作,及时总结试点经验和存在的问题;对符合条件的药品注册申请予以加快审评审批”,“下一步,争取年底前消化完药品注册申请积压存量”,“继续完善《药品注册管理办法》,尽快发布实施,确保受理、核查、检验、审评各环节顺畅衔接”。
徐霆对此建议,为了导向性地支持某类新药开发,在大临床(Ⅰ、Ⅱ、Ⅲ期)方面简政放权,将临床试验变成企业自己承担责任。CFDA只需对安全性有基本掌控,“宽进严出”,注重事后监管而非事前审批。
救命药贵,造新药更“贵”
2015年底,第三代抗癌靶向药奥斯替尼(Osimertinib)在美国上市,售价高达12750美元一盒,吃满一个月的量要花8万多人民币。据媒体今年8月报道,在国内没有替代新药,海外就医费用高昂的情况下,一些癌症患者亲属开始冒着触犯刑法风险,通过灰色购药链条,购买各种设备,自己合成原料药。
要想打破国内等效药的空白,唯一办法,就是加速国产新药创制进程。但救命药贵,造新药更“贵”。
一方面,生物药不像化学药,不是发现一个新的化学结构式那么简单,背后还需要复杂的生化反应、先进的生产工艺。另一方面,即便有了硬科技,那些“软件”能否跟上还不好说。如果缺乏符合cGMP标准的制药人才,缺乏有耐心的、多层次的资本市场,缺乏让新药尽快通过临床试验、新药注册、纳入医保的审批流程,那么,空有一腔热血的科研人创业,也有可能落得一曲悲歌。即便最终上市,过高的制度成本、要素匹配成本也附着在一颗颗药上,无形中推高了售价。
无论是研发企业、生产企业、投资机构,所有受访者都认同,这一现状需要改变。然而,他们都对前景保持谨慎乐观,如果鼓励新药创制无法蔚然成风,如果护航新药创制缺乏顶层设计,除非它们获得特别的政策庇荫,要不就只能让“风险”和“机遇”在一条叫“时间”的跑道上竞逐——俗称,听天由命。更多相关行业分析请查阅《2016-2021年中国生物制药行业发展分析及投资潜力研究报告》。
我们不希望“听天由命”成为肿瘤患者的宿命,同样不希望它成为中国生物药产业的宿命。癌魔固然猛烈,现在,我们需要一场更猛烈的体制变革。
免责声明:
1、本网转载文章目的在于传递更多信息,我们不对其准确性、完整性、及时性、有效性和适用性等作任何的陈述和保证。本文仅代表作者本人观点,并不代表本网赞同其观点和对其真实性负责。
2、中国商业数据网一贯高度重视知识产权保护并遵守中国各项知识产权法律。如涉及作品内容、版权和其它问题,请马上与本网联系更正或删除,可在线反馈、可电邮(sales@cn-bigdata.cn)、可电话(400-8778-269)。